BBMRI.at Legal Knowledge Base
Rechtliche Fragen und Antworten: Gibt es in der EU ein Biobankengesetz?
Derzeit gibt es keine einheitliche EU-weite Verordnung, die Biobanken und Biobanking explizit regelt. Es gibt jedoch einen bestehenden EU-Rahmen, welcher die nationalen Regelungen der EU-Mitgliedsstaaten ergänzt. Der Status Quo dieses Rahmens wird hier durch den BBMRI.at Legal Helpdesk veranschaulicht.
BBMRI.at Legal Helpdesk antwortet
Der BBMRI.at Legal Helpdesk Service beantwortet Fragen zu rechtlichen und regulatorischen Themen rund um Biobanking und/oder Verwendung biologischer Proben und Daten. Dieses Angebot steht BBMRI.at Partnern zur Verfügung. Biobanking und Forschung mit biologischen Proben und Daten (z.B. menschlich, Tier/veterinär, mikrobiell, etc.) kann rechtliche Fragen aufwerfen.
FRAGE:
Gibt es in der EU ein Biobank-Gesetz?
ANTWORT:
Derzeit gibt es keine einheitliche EU-weite Verordnung, die Biobanken und Biobanking explizit regelt. Es gibt jedoch einen bestehenden EU-Rahmen, der für einige Aspekte des Biobankwesens gilt – z. B. eine Verordnung über den Schutz personenbezogener Daten, der neben den nationalen Vorschriften der EU-Mitgliedstaaten zu diesem Thema besteht. Der Status Quo dieses Rahmens wird im Folgenden dargestellt (Englisch).
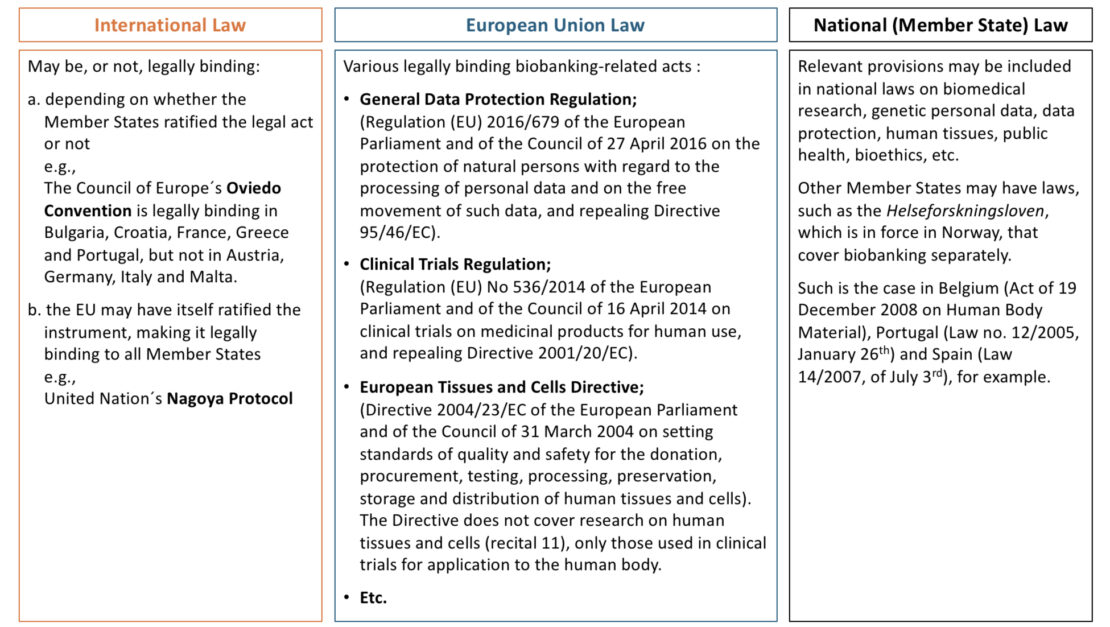
Dieser fragmentierte Rechtsrahmen (1) (wie in der obigen Tabelle dargestellt) ist zum Teil darauf zurückzuführen, dass der Gegenstand der biomedizinischen Forschung in der Vergangenheit von den Mitgliedstaaten und nicht von der EU gesetzlich geregelt wurde (2). Der vielleicht einflussreichste Rechtsakt der EU zum Thema Biobanking ist die Allgemeine Datenschutzverordnung (3) (DSGVO). Durch die Regulierung des Datenschutzes und insbesondere durch die Einführung einer normativen Regelung für den Datenschutz in der wissenschaftlichen Forschung, hat die DSGVO die Gesetzgebung und Praxis der wissenschaftlichen Forschung in den EU-Mitgliedstaaten beeinflusst (4). Dennoch führt die Umsetzung der DSGVO in den einzelnen Mitgliedstaaten zu unterschiedlichen Regulierungsergebnissen.
Künftige EU-Rechtsakte werden ebenfalls Auswirkungen auf das Biobanking innerhalb der EU haben und einige Bereiche vereinheitlichen. Beispiele dafür wären die Verordnung über den Europäischen Gesundheitsdatenraum (EHDS) (5) – eines ihrer Hauptmerkmale ist die Sekundärnutzung elektronischer Gesundheitsdaten, die für Biobanken von Nutzen sein wird. Ebenso wie das Gesetz über künstliche Intelligenz (KI) (6), welches unter anderem Bestimmungen enthält, wie die Sekundärnutzung elektronischer Gesundheitsdaten für KI-Training und -Tests), sowie auch die „SoHO-Verordnung“ (7).
Die in verschiedenen EU-Mitgliedstaaten geltenden Rechtsvorschriften, die sich speziell mit Biobanken befassen, sind in der nachstehenden Tabelle aufgeführt.
EU- Mitgliedsstaat
Gesetzgebungsakt Mitgliedsstaat
kutatások, valamint a biobankok működésének szabályairól
amended by Lei n.º 26/2016, de 22 de Agosto)
In den Rechtsvorschriften anderer Mitgliedstaaten (z. B. Österreich, Frankreich, Deutschland und Polen) wird Biobanking durch eine Kombination verschiedener Rechtsakte geregelt, die Themen wie biomedizinische Forschung, Datenschutz, Bioethik, öffentliche Gesundheit usw. abdecken (8).
Das Fehlen einer Verordnung für das Biobanking in der EU hat zur Folge, dass strukturelle Fragen im Zusammenhang mit der Biobankentätigkeit in den EU-Mitgliedstaaten unterschiedlich geregelt werden. Ein besonderes Problem sind die rechtlichen Beschränkungen, die von den einzelnen Mitgliedstaaten für die internationale (innerhalb und außerhalb der EU) gemeinsame Nutzung von Proben eingeführt wurden. Einige Länder verbieten den Transfer von Proben ins Ausland, was die grenzüberschreitende wissenschaftliche Forschung beeinträchtigt, während andere in dieser Hinsicht liberaler sind (9).
Die derzeitige Uneinheitlichkeit kann die Entwicklung der biomedizinischen Verbundforschung innerhalb der EU sowie zwischen der EU und Drittländern (10) behindern. Eine kurzfristige Vereinheitlichung könnte sich als zu ehrgeizig erweisen und ist aufgrund derzeitiger Umstände (11) (wie unterschiedliche Traditionen der Mitgliedstaaten im Umgang mit biomedizinischer Forschung und unterschiedlichen Auffassungen in Schlüsselfragen, wie zum Beispiel dem gewünschten Umfang der Zustimmung, die für Forschungsaktivitäten eingeholt werden sollte) nicht umsetzbar. Die Harmonisierung durch, […] die Entwicklung gemeinsamer Leitlinien, standardisierter Betriebsverfahren (SOPs) und Harmonisierungsmethoden […] ist von entscheidender Bedeutung“ (12). Wissenschaftler*innen haben auch auf andere Bereiche hingewiesen, in denen eine Harmonisierung innerhalb der EU von Vorteil wäre – so betrifft dies das „Vokabular“, das innerhalb der Biobankengemeinschaft verwendet wird („Proben“, „Anonymisierung“ usw.) (13), welches bereits auf BBMRI-ERIC-Ebene (14) angesprochen wurde, sowie die Klassifizierung der verschiedenen Arten von Biobanken, die ebenfalls innerhalb der EU variiert (15).
Die Verwirklichung eines EU-weiten Ansatzes zur Regulierung des Biobankwesens steht vor verschiedenen Herausforderungen und stößt auf unterschiedliche Unterstützung in den Mitgliedsstaaten (16). Auch andere europäische Organisationen, wie der Europarat, haben Leitlinien und Empfehlungen herausgegeben, um die Harmonisierung der Vorschriften für das Biobanking in den Mitgliedstaaten des Europarats und darüber hinaus zu fördern (siehe § 2 der Präambel der Empfehlung) (17).
Hinweis: Dies ist eine Übersetzung der ursprünglichen Antwort auf Englisch. Die ursprüngliche Antwort ist als PDF verfügbar (siehe unten). Im Zweifelsfall konsultieren Sie bitte die auf Englisch verfasste Version der Antwort.
Quellen:
(1) SLOKENBERGA, Santa. “Setting the Foundations: Individual Rights, Public Interest, Scientific Research and Biobanking.” GDPR and Biobanking: Individual Rights, Public Interest and Research Regulation across Europe (2021), S. 11-30, S. 12.
(2) Ibidem, p. 13.
(3) Regulation (EU) 2016/679 of the European Parliament and of the Council of 27 April 2016 on the protection of natural persons with regard to the processing of personal data and on the free movement of such data, and repealing Directive 95/46/EC (General Data Protection Regulation).
(4) SLOKENBERGA, Santa, a.a.O., S. 17.
(5) EUROPEAN COMMISSION, Proposal for a Regulation of the European Parliament and of the Council on the European Health Data Space – COM/2022/197 final (Document 52022PC0197).
(6) European Parliament legislative resolution of 13 March 2024 on the proposal for a regulation of the European Parliament and of the Council on laying down harmonised rules on Artificial Intelligence (Artificial Intelligence Act) and amending certain Union Legislative Acts (COM(2021)0206 – C9-0146/2021 – 2021/0106(COD)). The proposal “[…] does not apply to AI systems or AI models, including their output, specifically developed and put into service for the sole purpose of scientific research and development.” (Artikel 2(6)).
(7) EUROPEAN COMMISSION, Proposal for a Regulation of the European Parliament and of the Council on standards of quality and safety for substances of human origin intended for human application and repealing Directives 2002/98/EC and 2004/23/EC (Document 52022PC0338). The Regulation will not apply to research using substances of human origin when that research does not involve human application (recital 60).
(8) TZORTZATOU, Olga, et al. Biobanking across Europe post-GDPR: a deliberately fragmented landscape. Springer International Publishing, 2021, S. 397-414, S. 404.
(9) BEIER, Katharina & LENK, Christian. “Biobanking strategies and regulative approaches in the EU: recent perspectives.” Journal of Biorepository Science for Applied Medicine, 2015, S. 69-81, S. 78.
(10) KAYE, Jane. “Do we need a uniform regulatory system for biobanks across Europe?.” European Journal of Human Genetics 14.2, 2006, S. 245-248, S. 247.
(11) BEIER, Katharina & LENK, Christian, a.a.O., p. 72.
(12) GOTTWEIS, Herbert. Biobanks for Europe: A challenge for governance: Report of the expert group on dealing with ethical and regulatory challenges of international Biobank Research, European Union, 2012, S. 20.
(13) FRANSSON, Martin N., et al. “Toward a common language for biobanking.” European Journal of Human Genetics. 23.1, 2015, S. 22-28.
(14) Siehe: Lexikon– BBMRI Wiki (wikidot.com)
(15) BEIER, Katharina & LENK, Christian, a.a.O., S. 70.
(16) BIOBANKING AND BIOMOLECULAR RESOURCES RESEARCH INFRASTRUCTURE (BBMRI), Biobanks and the Public. Governing Biomedical Research Resources in Europe, 2013, S. 44. Verfügbar unter: BBMRI_Master_Galley.indd (bbmrieric.eu) (Zugriff: 09.05.2024).
(17) COUNCIL OF EUROPE, Recommendation CM/Rec(2016)6 of the Committee of Ministers to member States on research on biological materials of human origin.
Hinweis: Dieser Kommentar soll eine Zusammenfassung der wichtigsten ethischen und rechtlichen Fragen im Zusammenhang mit den von interessierten Kreisen gestellten Fragen bieten und sie auf die einschlägigen anwendbaren Rechtsvorschriften verweisen. Er schließt jedoch die Lektüre der offiziellen Rechtsquellen zu den in diesem Dokument behandelten Themen sowie der von den Autor*innen zitierten Rechtsquellen nicht aus und stellt keine Rechtsberatung dar.